Фізико-хімічні основи процесу очищення стічних вод
У разі досягнення значень розчинності в процесі очищення стічних вод забезпечується ГДК 10-1 -10-2 мг/дм3 важких металів. Проте загальновідомо, що при осаджувальному очищенні стічних вод гальванічного виробництва ГДК часто не досягається.
Гідроксиди важких металів, що одержуються при очищенні стічних вод, є сильно обводнюючі (99,5%) опади, розчинність яких залежить від безлічі чинників: рН, сольового складу, іонної сили розчину та інші.
Для з'ясування причин неповного осадження гідроксидів важких металів розглянемо процес їх утворення. З фізико-хімічної точки зору, це направлений гідроліз солей:
Men+ + nH2O = Me (OH) n +nH+ (1.4)
Користуючись цією схемою, розрахуємо значення рН осадження по формулі:
pH= - lg aН+ =![]() lg ПР - lg Kw - lg aMen+, (1.5)
lg ПР - lg Kw - lg aMen+, (1.5)
де ПР - коефіцієнт розчинності
Кw - іонний коефіцієнт води, 10-14
аМеn+ - активність іонів металів в розчині.
Залежність рН осадження від активності іонів металу в розчині приведена на рисунку 1.1
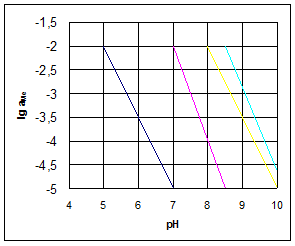
Рисунок 1.1 - Залежність рН почала утворення гідроксидів важких металів від активності металів в розчині.
Значення рН початку осадження, розраховані на підставі усереднених показників, а також значення рН, необхідні для забезпечення заданих залишкових концентрацій, приведені в таблиці 1.2
Таблиця 1.2 - Розрахункові показники осадження гідроксидів
|
Гідроксид |
Температура, °С |
РН початку осадження |
Задана концентрація іонів металлу, мг/дм3 |
Розрахункове значення рН |
|
Cu (OH) 2 |
18-20 |
4.17-8.04 |
0.2 |
6.93-10.8 |
|
Fe (OH) 2 |
18-25 |
6.34-7.11 |
0.3 |
8.98-9.75 |
|
Fe (OH) 3 |
18 |
1.53-2.03 |
0.3 |
3.29-3.79 |
|
Ni (OH) 2 |
17-25 |
4.97-7.1 |
0.1 |
7.86-9.99 |
|
Zn (OH) 2 |
18-25 |
5.55-7.66 |
3.0 |
7.72-9.83 |
Фактичні концентрації іонів металів після осадження значно відрізняються від табличних і можуть досягати десятків і сотень мг/дм3. Це обумовлено тим, що схема (рівняння - 1.4) не відображає дійсної картини, що відбувається в розчинах при утворенні гідроксидів важких металів, які в основі мають полівалентний катіон. Гідроліз таких катіонів протікає стадійно, а проміжними з'єднаннями є багатозарядні полікатіони типу [Mem (OH) n] kk (m-n) +. Ці з'єднання мають властивість зберігати свою стійкість аж до значень рН, близьких до рН гідратоутворення. Наприклад, в розбавлених мідьвмісних розчинах при рН=6.7 співіснують три форми продуктів гідролізу: Cu (OH) +, Cu2+ і Cu (OH) 2. При рН вище 7.4 переважаючою формою є нерозчинна форма Cu (OH) 2 з невеликою кількістю розчинної Cu (OH) 2. Ізоелектрична крапка для Cu (II) знаходиться в інтервалі рН=7.6.7.8, яка залежить від якісного складу розчину. Тому навіть незначні відхилення від оптимальних значень рН при очищенні води можуть привести до неповного очищення.
Цікаві статті з розділу
Заходи щодо зменшення пестицидного навантаження на агроекосистеми
Еколого-технологічна,
санітарно-гігієнічна характеристики та оцінка пестицидів. Збирання високих
урожаїв сільськогосподарських культур у сучасних умовах неможливе без захисту
рослин, який в ...
Аналіз діяльності підприємств
При розгляді першого питання розглянемо поняття
підприємства та обєднань, їх види та типи
Підприємництво в Україні здійснюється в будь-яких
організаційних формах, визначених законами Укра ...
Екологічний аудит, як основний інструмент екологічного менеджменту
Постановка проблеми. Основою розвитку світової
спільноти в XXI столітті за рішенням Конференції ООН з охорони навколишнього
середовища в Ріо-де-Жанейро (1992) прийнята концепція сталого розв ...
 Атмосфера завжди містить домішки природного та антропогенного походження. Основними забруднювачами є гази та тверді частинки.
Атмосфера завжди містить домішки природного та антропогенного походження. Основними забруднювачами є гази та тверді частинки. Розрізняють хімічне, фізичне та біологічне забруднення водоймищ. Хімічне зумовлюється збільшенням вмісту у воді шкідливих домішок.
Розрізняють хімічне, фізичне та біологічне забруднення водоймищ. Хімічне зумовлюється збільшенням вмісту у воді шкідливих домішок. Забруднення ґрунтів відбувається: під час видобутку корисних копалин, внаслідок захоронення відходів та сміття, внаслідок аварій та катастроф тощо.
Забруднення ґрунтів відбувається: під час видобутку корисних копалин, внаслідок захоронення відходів та сміття, внаслідок аварій та катастроф тощо.